Untuk pasien dengan penyakit radang usus, antibiotik bisa menjadi pedang bermata dua. Obat-obatan spektrum luas yang sering diresepkan untuk suar usus dapat membunuh mikroba yang bermanfaat di samping yang berbahaya, kadang-kadang memburuknya gejala dari waktu ke waktu. Saat melawan peradangan usus, Anda tidak selalu ingin membawa godam ke pertarungan pisau.
Para peneliti di MIT’s Computer Science and Artificial Intelligence Laboratory (CSAIL) dan McMaster University telah mengidentifikasi senyawa baru yang mengambil pendekatan yang lebih bertarget. Molekul, yang disebut enterololin, menekan sekelompok bakteri yang terkait dengan penyakit Crohn yang menyala-nyala sambil meninggalkan sisa mikrobioma sebagian besar utuh. Menggunakan model AI generatif, tim memetakan cara kerja kompleks, suatu proses yang biasanya memakan waktu bertahun -tahun tetapi dipercepat di sini menjadi hanya beberapa bulan.
“Penemuan ini berbicara tentang tantangan utama dalam pengembangan antibiotik,” kata Jon Stokes, penulis senior makalah baru tentang pekerjaan itu, asisten profesor biokimia dan ilmu biomedis di McMaster, dan afiliasi penelitian di klinik Abdul Latif Jameel MIT untuk pembelajaran mesin di bidang kesehatan. “Masalahnya tidak menemukan molekul yang membunuh bakteri dalam hidangan-kami sudah bisa melakukannya untuk waktu yang lama. Rintangan utama adalah mencari tahu apa yang sebenarnya dilakukan molekul-molekul itu di dalam bakteri. Tanpa pemahaman yang terperinci, Anda tidak dapat mengembangkan antibiotik tahap awal ini menjadi terapi yang aman dan efektif untuk pasien.”
Enterololin adalah langkah menuju antibiotik presisi: perawatan yang dirancang untuk merobohkan hanya bakteri yang menyebabkan masalah. Dalam model tikus peradangan seperti Crohn, obat ini memusatkan perhatianMereka memamerkan dinginbakteri yang tinggal di usus yang dapat memperburuk suar, sambil meninggalkan sebagian besar penghuni mikroba lainnya yang tidak tersentuh. Tikus yang diberikan enterololin pulih lebih cepat dan mempertahankan microbiome yang lebih sehat daripada yang diobati dengan vankomisin, antibiotik yang umum.
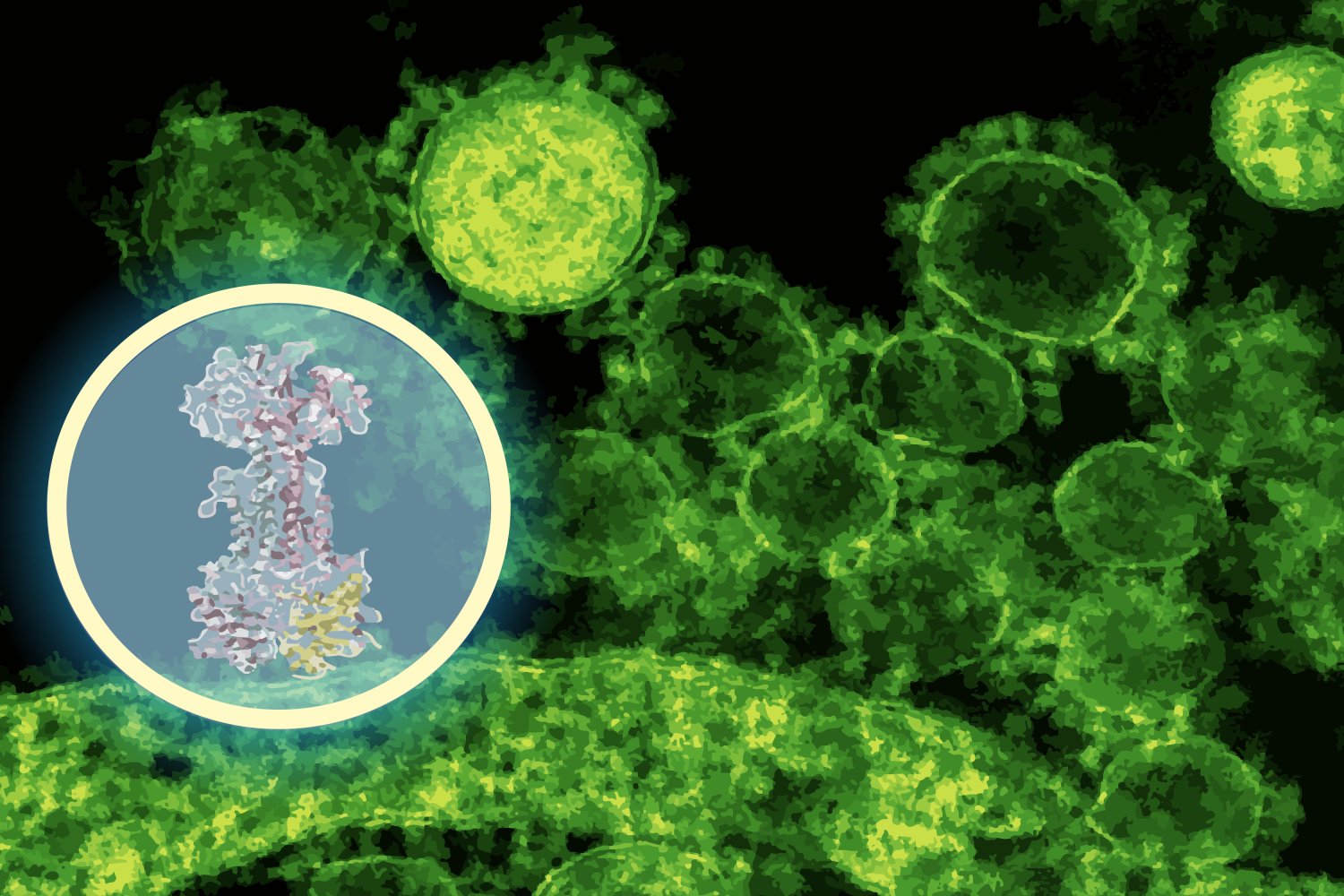
Menurunkan mekanisme aksi obat, target molekulernya mengikat di dalam sel bakteri, biasanya membutuhkan bertahun -tahun percobaan yang melelahkan. Laboratorium Stokes menemukan enterololin menggunakan pendekatan penyaringan throughput tinggi, tetapi menentukan targetnya adalah hambatan. Di sini, tim beralih ke Diffdock, model AI generatif yang dikembangkan di CSAIL oleh mahasiswa MIT PhD Gabriele Corso dan profesor MIT Regina Barzilay.
Diffdock dirancang untuk memprediksi bagaimana molekul kecil masuk ke dalam kantong protein yang mengikat, masalah yang sangat sulit dalam biologi struktural. Algoritma docking tradisional mencari melalui orientasi yang mungkin menggunakan aturan penilaian, seringkali menghasilkan hasil yang bising. Diffdock sebagai gantinya membingkai docking sebagai masalah penalaran probabilistik: model difusi secara iteratif memurnikan tebakan sampai konvergen pada mode pengikatan yang paling mungkin.
“Hanya dalam beberapa menit, model tersebut memperkirakan bahwa enterololin berikatan dengan kompleks protein yang disebut LOLCDE, yang sangat penting untuk mengangkut lipoprotein pada bakteri tertentu,” kata Barzilay, yang juga memimpin ikut klinik Jameel. “Itu adalah timah yang sangat konkret – yang dapat memandu eksperimen, daripada menggantikannya.”
Kelompok Stokes kemudian menguji prediksi itu. Menggunakan prediksi difdock sebagai GPS eksperimental, mereka pertama kali mengembangkan mutan yang resistan terhadap enterololinE. coli Di laboratorium, yang mengungkapkan bahwa perubahan dalam DNA mutan yang dipetakan ke LOLCDE, tepatnya di mana difdock memprediksi enterololin untuk mengikat. Mereka juga melakukan sekuensing RNA untuk melihat gen bakteri mana yang dinyalakan atau dimatikan ketika terpapar obat, serta menggunakan CRISPR untuk secara selektif merobohkan ekspresi target yang diharapkan. Eksperimen laboratorium ini semuanya mengungkapkan gangguan pada jalur yang terkait dengan transportasi lipoprotein, persis apa yang diprediksi Diffdock.
“Ketika Anda melihat model komputasi dan data lab basah yang menunjuk ke mekanisme yang sama, saat itulah Anda mulai percaya bahwa Anda telah menemukan sesuatu,” kata Stokes.
Untuk Barzilay, proyek ini menyoroti perubahan dalam cara AI digunakan dalam ilmu kehidupan. “Banyak penggunaan AI dalam penemuan obat adalah tentang mencari ruang kimia, mengidentifikasi molekul -molekul baru yang mungkin aktif,” katanya. “Apa yang kami tunjukkan di sini adalah bahwa AI juga dapat memberikan penjelasan mekanistik, yang sangat penting untuk memindahkan molekul melalui pipa pengembangan.”
Perbedaan itu penting karena studi mekanisme aksi seringkali merupakan langkah pembatasan tingkat utama dalam pengembangan obat. Pendekatan tradisional dapat memakan waktu 18 bulan hingga dua tahun, atau lebih, dan menelan biaya jutaan dolar. Dalam hal ini, tim MIT -MCMASTER memotong timeline menjadi sekitar enam bulan, dengan sedikit biaya.
Enterololin masih dalam tahap awal pengembangan, tetapi terjemahan sudah berlangsung. Perusahaan pemintalan Stokes, Stoked Bio, telah melisensikan senyawa dan mengoptimalkan propertinya untuk potensi penggunaan manusia. Pekerjaan awal juga mengeksplorasi turunan dari molekul terhadap patogen resisten lainnya, sepertiKlebsiella pneumoniae. Jika semuanya berjalan dengan baik, uji klinis dapat dimulai dalam beberapa tahun ke depan.
Para peneliti juga melihat implikasi yang lebih luas. Antibiotik spektrum sempit telah lama dicari sebagai cara untuk mengobati infeksi tanpa kerusakan jaminan pada microbiome, tetapi mereka sulit ditemukan dan divalidasi. Alat AI seperti Diffdock dapat membuat proses itu lebih praktis, dengan cepat memungkinkan generasi baru antimikroba yang ditargetkan.
Untuk pasien dengan CROHN dan kondisi radang usus lainnya, prospek obat yang mengurangi gejala tanpa mengganggu kestabilan microbiome dapat berarti peningkatan yang berarti dalam kualitas hidup. Dan dalam gambaran yang lebih besar, antibiotik presisi dapat membantu mengatasi ancaman resistensi antimikroba.
“Yang menggairahkan saya bukan hanya senyawa ini, tetapi gagasan bahwa kita dapat mulai berpikir tentang mekanisme penjelasan aksi sebagai sesuatu yang dapat kita lakukan lebih cepat, dengan kombinasi AI, intuisi manusia, dan eksperimen laboratorium yang tepat,” kata Stokes. “Itu berpotensi mengubah cara kami mendekati penemuan obat untuk banyak penyakit, bukan hanya Crohn.”
“Salah satu tantangan terbesar bagi kesehatan kita adalah peningkatan bakteri tahan antimikroba yang menghindari bahkan antibiotik terbaik kita,” tambah Yves Brun, Profesor di Universitas Montreal dan Profesor Emeritus terkemuka di Indiana University Bloomington, yang tidak terlibat dalam kertas. “AI menjadi alat penting dalam perjuangan kami melawan bakteri ini. Penelitian ini menggunakan kombinasi metode AI yang kuat dan elegan untuk menentukan mekanisme aksi kandidat antibiotik baru, sebuah langkah penting dalam pengembangan potensial sebagai terapi.”
Corso, Barzilay, dan Stokes menulis makalah itu dengan para peneliti McMaster Denise B. Catacutan, Vian Tran, Jeremie Alexander, Yeganeh Yousefi, Megan Tu, Stewart McLellan, dan Dominique Tertigas, dan profesor Jakobolan, Michael Surette, Eric Brown, dan Brian Coomb. Penelitian mereka didukung, sebagian, oleh Weston Family Foundation; Pusat Penemuan Antibiotik David Braley; Institut Penelitian Kesehatan Kanada; Dewan Penelitian Ilmu Pengetahuan Alam dan Teknik Kanada; M. dan M. Heersink; Institut Kanada untuk Penelitian Kesehatan; Penghargaan Beasiswa Pascasarjana Ontario; Klinik Jameel; dan Badan Pengurangan Ancaman Pertahanan AS Penemuan penanggulangan medis terhadap program ancaman baru dan yang muncul.
Para peneliti memposting data sekuensing dalam repositori publik dan merilis kode DiffDock-L secara terbuka di GitHub.